技术服务部
Technical Service Department
双重ddPCR对重组腺相关病毒载体的滴定完整性评价
重组腺相关病毒载体(Recombination adeno-associated virus, rAAV)是在非致病的野生型AAV基础上改造而成的基因载体,由于其种类多样、免疫原性极低、安全性高、宿主细胞范围广(对分裂细胞和非分裂细胞均具有感染能力)、扩散能力强、体内表达基因时间长等,rAAV被视为最有前途的基因研究和基因治疗载体之一。
重组腺相关病毒(rAAV)基因组拷贝数的精确滴定与临床前和临床环境中正确给药剂量直接相关,建立标准、准确和可重复的重组腺相关病毒(rAAV)基因组拷贝数定量的方法是基因治疗产品中工艺开发和优化的重要环节。
方法
目前两种常见测定rAAV基因组滴度策略
方法一:
针对特定的转基因序列或者polyA序列来设计qPCR引物探针,但由于不同AAV载体中转基因及polyA序列的可变性,因此该方法并不是一种通用的rAAV滴度测定方法。
方法二:
将qPCR引物探针设计在rAAV载体的ITR上,由于大部分研究者采用酶切线性化的方法,将两个ITR以及两者之间的转基因表达盒连同部分骨架序列回收作为标准品,导致同一样品的滴度测定出现了实验室间及实验室内的偏差。
实时荧光定量PCR技术,用于重组腺相关病毒(rAAV)基因组拷贝数的滴定检测存在标准品建立复杂和定量重复性差的问题。数字PCR(dPCR)技术,可直接定量重组腺相关病毒(rAAV)基因组拷贝数、无需依赖标准品和标准曲线,对抑制物耐受程度高,尤其适用于未纯化的病毒裂解样品的定量检测。
rAAV检测流程
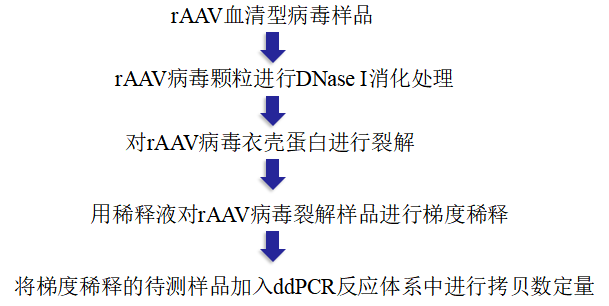
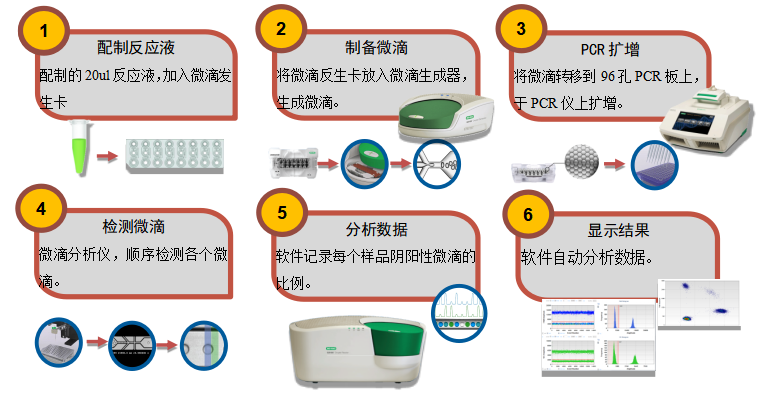
数字PCR操作流程
相关文献研究
Birei等研究文章结果显示,当限制性内切酶处理不同构象的标准质粒DNA时,qPCR测定的rAAV2RSM的载体基因组拷贝数发生了显著变化,说明qPCR扩增受标准质粒二级结构的影响较大。相比之下,在目标位点的不同位置使用引物探针或载体基因组的二级结构构象不影响ddPCR测定的载体基因组拷贝数(如下图1所示)。
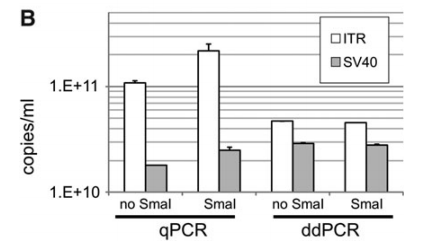
图1:来源参考文献1
该研究中使用Bio-Rad QX200 ddPCR,从液滴荧光的2D图中可获得rAAV载体基因组的完整信息。使用该技术,我们可以用SV40和ITR引物探针同时检测rAAV2 vg的质量,分别用FAM(通道1检测)和HEX(通道2检测)标记。如图2所示,将具有FAM和HEX信号的液滴分布分为四组:一个双阳性组(SV40+/ITR+组,含完整vg),两个单阳性组(SV40+/ITR-组和SV40-/ITR+组,含不完整vg),一个双阴性组(SV40-/ITR-组,液滴不含PCR产物)。2D ddPCR还可用于鉴定rAAV载体中的杂质,为了证明这一点,该研究选择了两组针对ITR(在rAAV vg区域内)和一个复制起点(ori,在质粒骨干内)的引物探针,分别用HEX和FAM标记它们,并进行了2D ddPCR分析(ori和ITR 2D ddPCR)(图3),与SV40和ITR引物探针组的液滴分布相似,具有FAM和HEX信号的液滴分布为四组:ori+/ITR+组(载体质粒),ori+/ITR-基团(质粒骨干杂质),ori-/ITR+组(rAAV候选组)和ori-/ITR-组,这些在qPCR平台是无法实现的。
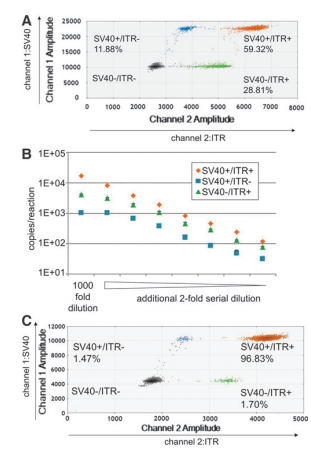
图2:来源参考文献1
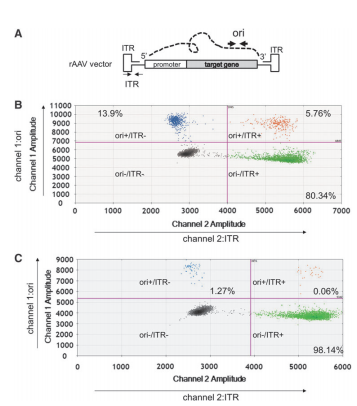
图3:来源参考文献1
参考文献
1、Birei Furuta-Hanawa, et al. Two-Dimensional Droplet Digital PCR as a Tool for Titration and Integrity Evaluation of Recombinant Adeno-Associated Viral Vectors. HUMAN GENE THERAPY METHODS 2019.
2、 Wang Y, et al. A qPCR method for AAV genome titer with ddPCR-level of accuracy and precision. Mol Ther Methods Clin Dev 2020;19:341–346.

电话:021-61283010
网址:www.bio-chain.com
邮箱:marketing@bio-chain.com
地址:上海市徐汇区虹漕路421号65幢303室
上海柏辰生物科技有限公司 版权所有 严禁复制 网站备案号:沪ICP备09099502号-1 沪公网安备 31010402002899号 网站建设:铭心科技



