新闻中心
NEWS
【文章分享】小鼠人源化肝脏代谢景观的全面基因分析
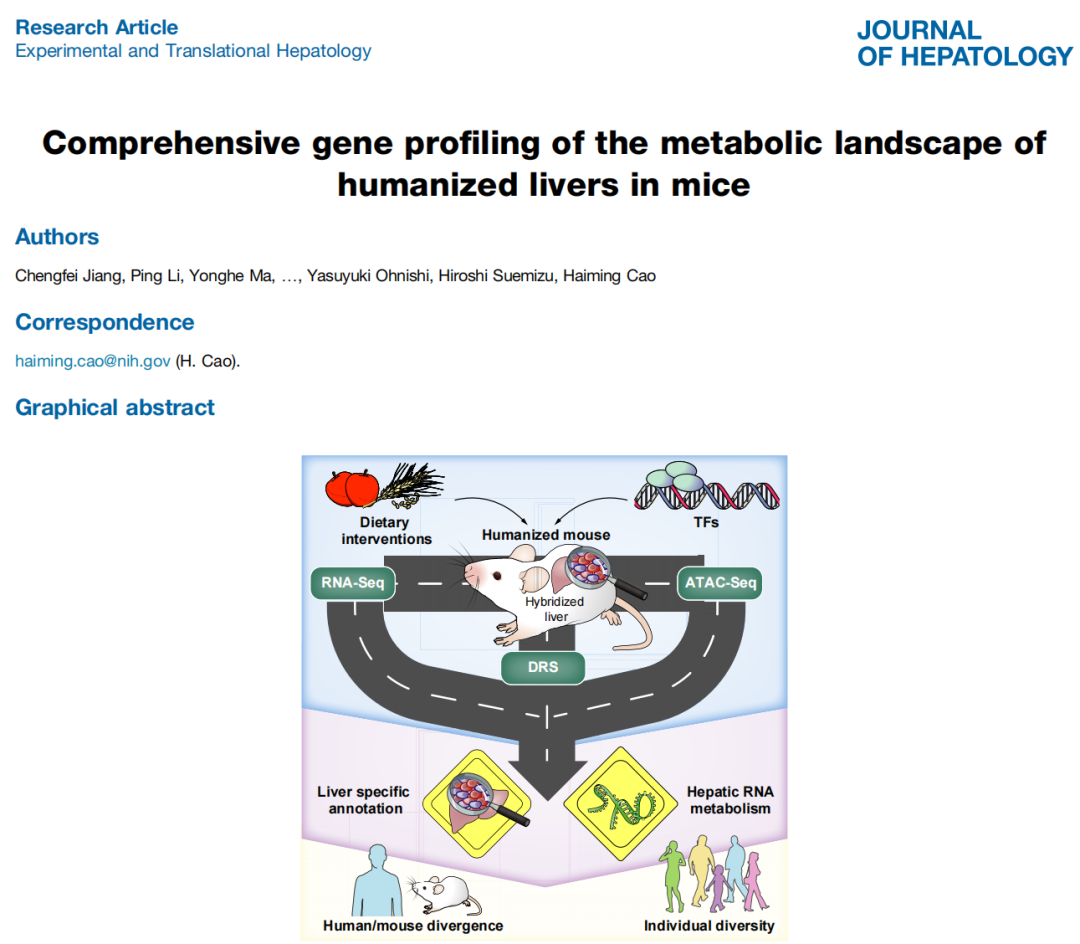
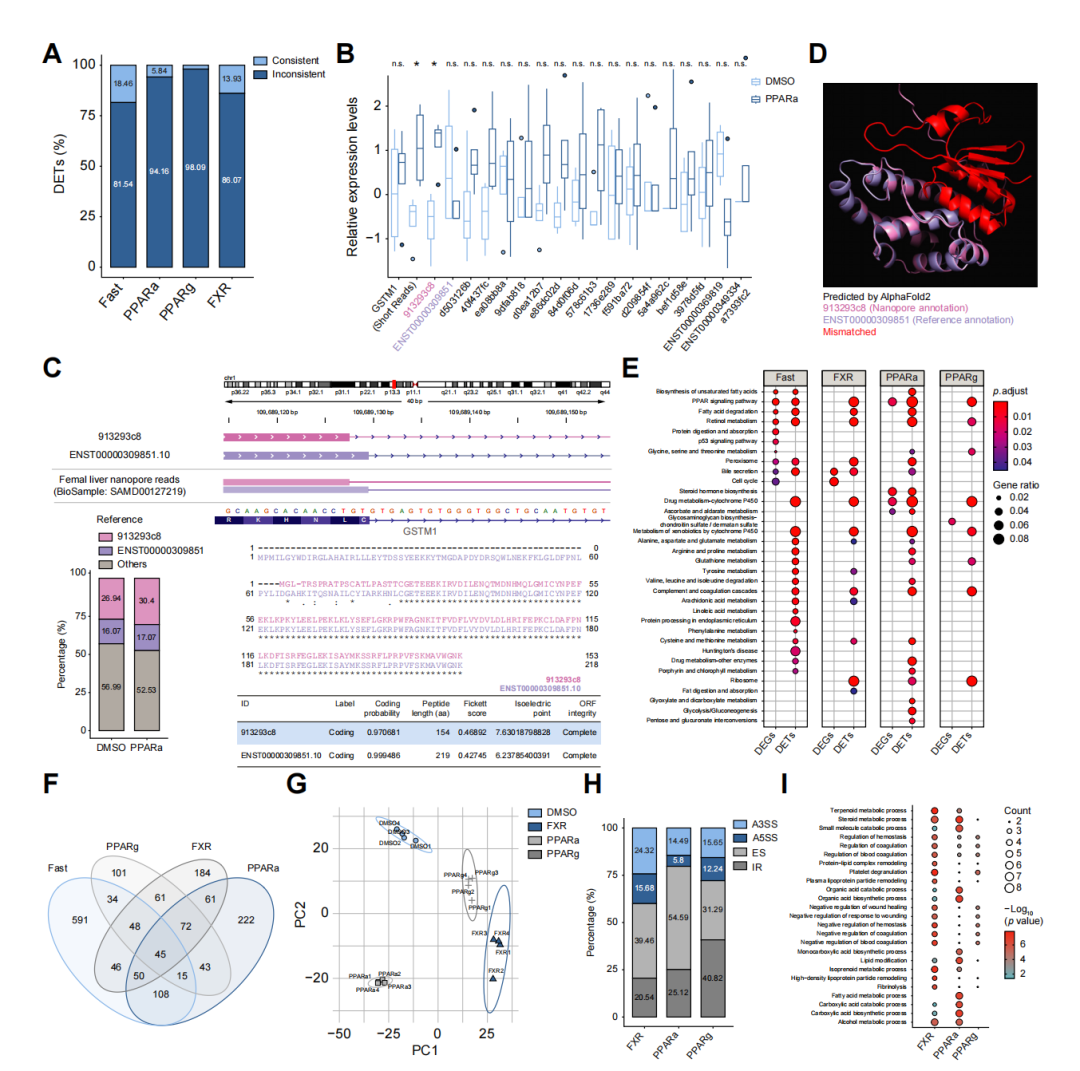
标题:Comprehensive gene profiling of the metabolic landscape of humanized livers in mice 中文标题:小鼠人源化肝脏代谢景观的全面基因分析 期刊全称:Journal of Hepatology 影响因子:25 发布时间:2023年12月3日 原文链接:https://www.journal-of-hepatology.eu/article/S0168-8278(23)05296-0/abstract 01 研究目的 目的:使用Nanopore探索复杂动态的人类肝脏转录组,建立人类肝脏转录组的从头注释。 ❖人类肝脏转录组是复杂且高度动态的,例如,一个基因可以产生多个不同的转录物,每个转录物具有不同的转录后修饰。 ❖人类肝脏无法直接接受处理,并且人类肝脏转录组在转录和RNA修饰水平上的注释不足,这在很大程度上掩盖了对人类肝脏转录组的直接了解。 02 研究方法 ❖作者培育了携带相同遗传背景的人源化肝脏小鼠。 ❖这些小鼠嵌入的人源化肝细胞分别来自两个不同死亡原因的供体,并且对小鼠进行了饥饿以及不同转录因子(TFs)的代谢处理。 ❖作者使用无核酸酶水将75 μg的提取的RNA调整至100 μL体积。随之,使用Dynabeads™ mRNA 纯化试剂盒富集poly(A)尾RNA,并将500 ng的具有poly(A)尾RNA用于Nanopore直接RNA测序 (Oxford Nanopore Technologies ,DRS)。采用SQK-RNA002试剂盒方案进行文库构建,同时,建库过程中也采纳了ONT推荐的可选逆转录步骤的建议。将构建好的文库加载到ONT R9.4.1流动槽(Oxford Nanopore Technologies)上,并使用GridION平台进行测序。通过测序数据分析人源化肝脏小鼠,确定所有RNA转录亚型的表达水平、m6A修饰和poly(A)尾长度。 ❖对人类和小鼠之间以及两个个体之间的基因调控进行了比较分析。 03 研究结果 ❖为了建立人类肝脏转录组的从头注释,作者首先对来自同一供体的人源化肝脏小鼠进行饮食干预和转录因子激活处理,并结合Nanopore直接RNA测序、illumina短读长测序以及ATAC测序的结果来分析RNA代谢调节。由此,作者发现了大量新基因和转录本,还发现了许多受调控的代谢途径。 ❖ 作者扩展了人和小鼠肝脏转录组的从头注释,与参考注释中的亚型相比,54.6%的人类和70.8%的小鼠转录本亚型是新的。作者评估了这些新转录本的基因的亚型组成,发现超过40%的这些新转录本显示出与当前参考数据库中的蛋白质编码序列不同。作者在基因间区域中鉴定了212个新基因,并随机克隆了一些新基因,验证了分析结果的可靠性。随之,作者进行通路富集分析,表明hNovel3与类固醇生物合成通路相关,并将基因敲除后,佐证了这一观点。 ❖m6A和poly(A)尾长在调节RNA代谢和生理过程中发挥着关键作用。作者使Nanopore DRS测序分析m6A修饰时发现,m6A修饰修饰位点在编码区域和3 ‘UTR区域中富集。通过PCA分析发现,与对照组相比,进行饮食干预和转录因子激活处理后的人源化肝脏小鼠,3’UTR中m6A修饰存在显着差异,而在编码序列区域中没有发现这种差异。经过通路分析表明,这些差异调节的m6A修饰发生在脂肪酸和酒精代谢中关键代谢基因的转录本上。 ❖Nanopore的DRS测序可以精确确定转录本上的poly(A)尾长度。作者发现人源化肝脏中所有人类转录物上poly(A)尾长的平均长度约为100个核苷酸,并且,转录本的poly(A)尾长度与其表达水平呈负相关趋势。通过方差分析发现,与对照组相比,进行饮食干预和转录因子激活处理的人源化肝脏小鼠,转录本上的poly(A)尾长度的分布因基因而异。经过通路分析表明,经过转录因子FXR, PPARα, and PPARγ激活处理,均影响poly(A)尾长的主要代谢通路。 ❖遗传背景对个体的基因调控和疾病易感性有很大影响。作者通过两个供体之间的测序结果评估个体之间转录组的差异。作者发现在第二个供体(供体2)中检测到的大约55%的RNA转录本与第一个供体(供体1)中的RNA转录本相匹配,但是仍有约20%的转录亚型存在明显差异。例如,通过纳米孔DRS在供体2中检测到新基因ebabaf4b的全长,在供体1中未检测到信号。并且,两个供体中转录本的一致变化都参与了主要的代谢途径,而相反调节的基因大多富集在炎症防御反应中。 图:人源化肝脏小鼠中RNA转录本的m6A修饰和poly(A)尾长的动态 04 总结 ❖肝脏特异性人源化小鼠使人类肝细胞可以在生理背景下接受多种处理。 ❖通过在不同条件下对肝脏特异性人源化小鼠模型进行纳米孔Nanopore直接RNA测序 (DRS) ,建立人类肝脏转录组的从头注释。 ❖针对人类肝脏转录组的转录水平进行分析,鉴定了许多使用传统技术无法发现的调节代谢途径。 ❖Nanopore直接RNA测序(DRS)揭示了人类肝脏转录本的m6A和poly(A)尾长响应代谢刺激的动态变化。 ❖不同遗传背景的个体表现出不同的基线转录组结构。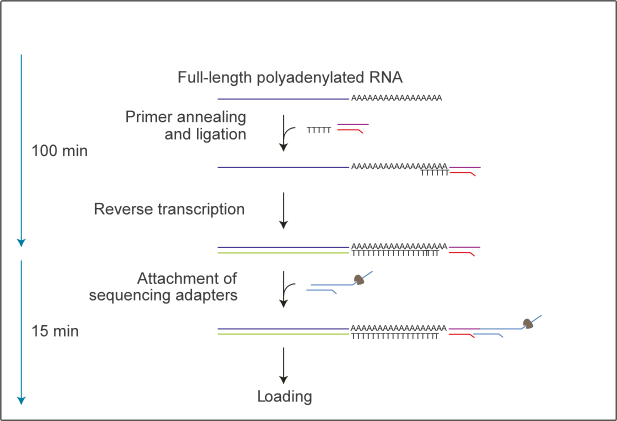

电话:021-61283010
网址:www.bio-chain.com
邮箱:marketing@bio-chain.com
地址:上海市徐汇区虹漕路421号65幢303室
上海柏辰生物科技有限公司 版权所有 严禁复制 网站备案号:沪ICP备09099502号-1 沪公网安备 31010402002899号 网站建设:铭心科技



