新闻中心
NEWS
揭秘WB | WB实验的“样品制备必修课”:蛋白质怎么溶?怎么稳?
Western Blot——样品制备
在科研的道路上,WB实验如同一场精密的蛋白质“寻宝之旅”,每一个步骤都至关重要。然而,许多初学者在实验过程中遇到的常见问题,往往都与样品制备环节细节把控不足有关。选择合适的裂解液和还原剂、添加蛋白酶抑制剂、正确使用缓冲液,是提升实验可重复性和结果准确性的必要手段。因此,掌握蛋白质溶解和稳定化的技巧,不仅有助于提升实验效率,更能为科研成功的可靠性打下坚实基础。
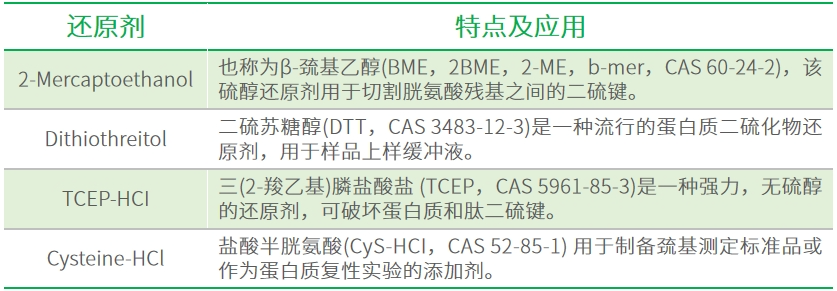
蛋白质溶解 为确保电泳顺利进行,必须有效消除蛋白质之间的聚集作用。理想的做法是在电泳样品缓冲液中同步完成细胞裂解与蛋白溶解。若无法实现这一操作,则需在专门的增溶溶液中提取蛋白,该溶液应包含去垢剂、变性剂和/或还原剂,并使用与电泳兼容的缓冲体系。裂解缓冲液通常含有多种去垢剂,有助于破坏细胞结构、释放蛋白质并促使其充分溶解。然而,由于不同蛋白质的理化性质各异,其对缓冲液成分及去垢剂的响应也可能存在差异。若目标蛋白未能有效溶解,或其蛋白-蛋白相互作用具有特殊性,则需尝试其他特制缓冲液,并通过置换或去除原有去垢剂来优化溶解条件。 缓冲液使用的一般原则 全细胞裂解物和膜结合蛋白:常用的裂解缓冲液包括RIPA和NP-40。其中,RIPA因其较强的裂解能力,特别适用于提取难溶性膜蛋白。 核/线粒体蛋白:通常优先选择RIPA缓冲液,但为提高特定细胞器及目标蛋白的回收效率,常采用分级分离策略以增强富集效果。 细胞质蛋白:在某些情况下,Tris-HCl缓冲液可能比RIPA更具优势,具体条件需通过实验优化,以实现目标蛋白的最大化提取。 天然状态蛋白质:CHAPS作为一种两性离子去垢剂,能有效维持蛋白质的天然构象,因此广泛应用于等电聚焦(IEF)和二维电泳(2-D PAGE)等需要保持蛋白天然状态的技术中。 常用的裂解缓冲液配方 常用的还原剂 多种蛋白质可通过二硫键交联形成多聚体结构。添加还原剂能够有效断裂这些二硫键,促使蛋白质解聚为单体形式。以下是几种常用的还原剂及其典型应用场景。 蛋白质稳定化 细胞裂解后,胞内酶类(如蛋白酶和磷酸酶)仍具有活性,可能导致目标蛋白发生降解、去磷酸化或构象改变。为最大限度抑制这些酶的活性,样品制备过程应全程在冰上或4℃环境下进行,并在裂解缓冲液中添加相应的蛋白酶和/或磷酸酶抑制剂。此外,裂解缓冲液建议现用现配,以确保其有效性。实验人员既可选用市售的即用型复合抑制剂(通常为专利配方),也可根据具体实验需求自行配制抑制剂混合液。下表汇总了常用的蛋白酶和磷酸酶抑制剂、各自的作用靶点,以及在裂解缓冲液中的推荐终浓度。 常用蛋白酶抑制剂 常用磷酸酶抑制剂 样品缓冲液配置技巧 防止降解:离心混合后,应立即加入裂解缓冲液及蛋白酶抑制剂混合物,以有效抑制蛋白水解。为获得较高的蛋白提取效率,有时需采用不同浓度的蛋白酶抑制剂组合,并重复裂解步骤。 定量样品:测定样品中总蛋白含量有助于确保各泳道上样量一致,从而实现均等电泳加载。在需要比较不同处理组(如对照与实验组)中目标蛋白表达水平时,准确的定量尤为重要。保持上样量一致可减少后续数据分析中的归一化误差。 去除不溶物:固体颗粒可能堵塞凝胶孔道,影响电泳效果。因此,在电泳前需将裂解后的细胞匀浆在15°C下以20,000 ×g离心15分钟,以充分沉淀并去除所有不溶性成分。 了解更多 如果您想获取更多关于WB技术、相关产品、实验方法等干货,请填写以下二维码表单,我们会尽快与您取得联系! 扫码填写信息 解锁专属技术资讯




电话:021-61283010
网址:www.bio-chain.com
邮箱:marketing@bio-chain.com
地址:上海市徐汇区虹漕路421号65幢303室
上海柏辰生物科技有限公司 版权所有 严禁复制 网站备案号:沪ICP备09099502号-1 沪公网安备 31010402002899号 网站建设:铭心科技



